
近日,复旦大学生命科学学院余巍研究员与上海交通大学医学院附属新华医院崔龙教授课题组合作发现长寿基因SIRT3调控一碳单位代谢酶参与结直肠癌发生的新分子机制,为开发治疗结直肠癌的靶向药物提供了坚实的理论基础。10月26日,相关研究成果以《SIRT3去乙酰化丝氨酸羟甲基转移酶2(SHMT2)促进结直肠癌的发生》为题(“Deacetylation of Serine Hydroxymethyl-transferase 2 by SIRT3 promotes Colorectal Carcinogenesis”)在线发表在《自然·通讯》(Nature Communications)杂志上。
研究人员发现,线粒体主要去乙酰化酶SIRT3在葡萄糖饥饿的情况下,能直接结合一碳单位代谢通路中一个关键代谢酶-丝氨酸羟甲基转移酶2(SHMT2),并能去除SHMT2 K95的乙酰化修饰,稳定SHMT2的细胞内表达以及维持SHMT2的高活性。SHMT2主要负责细胞内丝氨酸和甘氨酸的相互转换,高活性的SHMT2能帮助细胞抵抗线粒体的活性氧压力,并保证细胞内生物大分子的供应从而满足癌细胞快速增殖的需要。
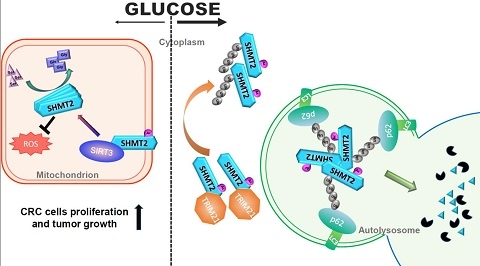
图1. 模式图(低葡萄糖促进SIRT3去乙酰化SHMT2,帮助提供细胞快速增殖需要的氨基酸;高葡萄糖导致高度乙酰化的SHMT2,进入溶酶体降解,抑制细胞快速增殖)
研究人员在结直肠癌病人样本中发现,SIRT3和SHMT2协同高表达,相应地SHMT2 K95的乙酰化程度低。高表达SIRT3或SHMT2的结直肠癌病人术后总存活率低,预后差。对SHMT2 K95的乙酰化修饰促进了E3连接酶TRIM21的结合,并导致乙酰化的SHMT2通过K63多聚泛素依赖的大自噬途径降解。这种修饰也削弱了结直肠癌细胞的增殖速率和成瘤能力。在诱导的小鼠肠炎模型中,Sirt3基因的缺失显著降低小鼠小肠的肿瘤大小和数量。免疫组化染色表明Sirt3 敲除小鼠的肿瘤细胞中SHMT2的表达量明显减少。本研究还对SHMT2突变体进行了结构解析,发现SHMT2 K95突变成R/Q则破坏了SHMT2完整的功能性四聚体结构,从而降低了其对底物丝氨酸的亲和,降低酶的活性。此研究揭示了SIRT3-SHMT2调控轴在结直肠癌发生中发挥的作用,为开发靶向SIRT3-SHMT2调控轴治疗结直肠癌的靶向药物提供了坚实的理论基础。

